Version interactive avec LaTeX compilé
A 00 PHYS. I
ÉCOLE NATIONALE DES PONTS ET CHAUSSÉES, ÉCOLES NATIONALES SUPÉRIEURES DE L'AÉRONAUTIQUE ET DE L'ESPACE, DE TECHNIQUES AVANCÉES, DES TÉLÉCOMMUNICATIONS, DES MINES DE PARIS, DES MINES DE SAINT-ÉTIENNE, DES MINES DE NANCY, DES TÉLÉCOMMUNICATIONS DE BRETAGNE, ÉCOLE POLYTECHNIQUE (FILIÈRE TSI)
CONCOURS D'ADMISSION 2000
PREMIÈRE ÉPREUVE DE PHYSIQUE
Filière PC
(Durée de l'épreuve :
Sujet mis à disposition du concours ENSTIM, INT, TPE-EIVP
Les candidats sont priés de mentionner de façon apparente sur la première page de la copie :
PHYSIQUE I -PC
L'énoncé de cette épreuve, particulière aux candidats de la filière PC, comporte 8 pages.
PREMIÈRE ÉPREUVE DE PHYSIQUE
Filière PC
(Durée de l'épreuve :
Sujet mis à disposition du concours ENSTIM, INT, TPE-EIVP
Les candidats sont priés de mentionner de façon apparente sur la première page de la copie :
PHYSIQUE I -PC
L'énoncé de cette épreuve, particulière aux candidats de la filière PC, comporte 8 pages.
- Si, au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur d'énoncé, il le signale sur sa copie et poursuit sa composition en expliquant les raisons des initiatives qu'il est amené à prendre.
- Tout résultat fourni dans l'énoncé peut être utilisé pour les questions ultérieures, même s'il n'a pas été démontré.
- Il ne faudra pas hésiter à formuler les commentaires (incluant des considérations numériques) qui vous sembleront pertinents, même lorsque l'énoncé ne le demande pas explicitement. Le barème tiendra compte de ces initiatives ainsi que des qualités de rédaction de la copie.
L'épreuve comprend deux problèmes indépendants entre eux, et qui pourront être traités dans l'ordre que l'on voudra. Le premier étudie l'irréversibilité d'une évolution, le second s'intéresse à une manière de tendre vers la réversibilité. Les diverses parties de ces problèmes sont liées par le sens et certains de leurs résultats sont analogues.
PROBLÈME I : IRRÉVERSIBILITÉ ET FONCTION G*
Toute évolution spontanée d'un système quelconque génère une création d'entropie. Quand le système est en interaction avec une source unique, l'irréversibilité de la transformation est calculable à partir d'une fonction, nommée
1. Cas du Fluide Parfait
1.1. Déséquilibre mécanique
Un corps de pompe horizontal contient une mole de gaz parfait dans les conditions de
température et de pression
température et de pression
L'atmosphère extérieure est une source d'énergie thermique et de travail. Sa température est notée

Fig. 1 : piston, à
1.2. Déséquilibre thermique
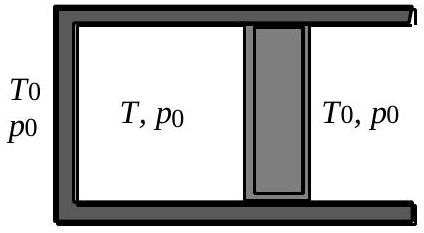
Fig. 2 :
La géométrie du système est la même que la précédente, mais le piston et le corps de pompe sont maintenant recouverts d'un isolant thermique. Le gaz est dans les conditions de température
1.3. Déséquilibre thermodynamique
Dans les conditions initiales les plus générales, on note
1.4. La fonction
On considère (fig. 3) la transformation la plus générale où le gaz est en déséquilibre thermodynamique aux deux instants initial et final. Pratiquement, on bloque le piston avant
que l'équilibre mécanique soit atteint et on remet en place l'isolant thermique. Le gaz est alors dans l'état (
que l'équilibre mécanique soit atteint et on remet en place l'isolant thermique. Le gaz est alors dans l'état (
On définit la fonction
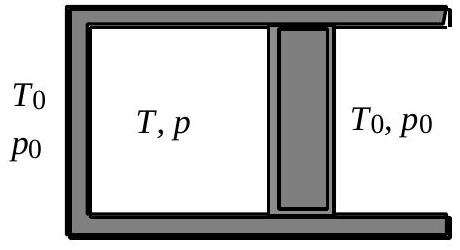
Fig. 3a : état initial
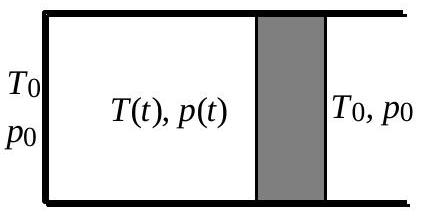
Fig. 3b : état intermédiaire
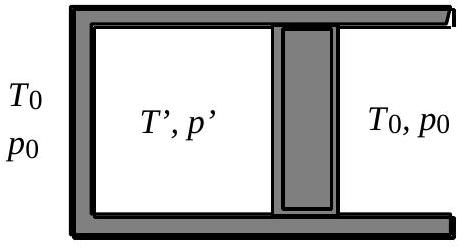
Fig. 3c : état final
8 - La situation de déséquilibre mécanique (section 1.1) est définie par
2. Cas d'un système diphasé
La figure 4a décrit la situation : à l'instant
À
A l'instant
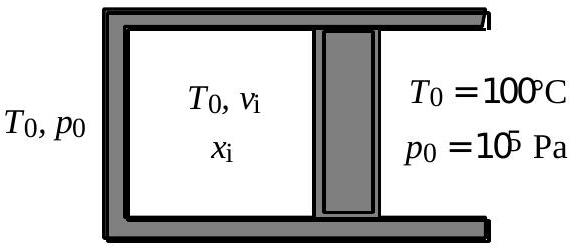
Fig. 4a : état initial
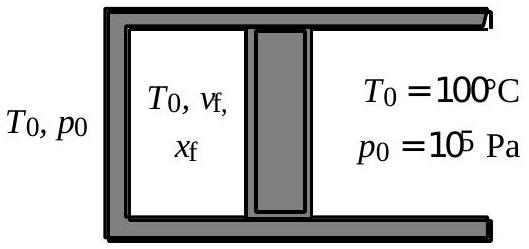
Fig.
9 - Déterminer les titres molaires initial
10 - Exprimer littéralement puis numériquement les variations d'énergie interne
11 - Le piston est à nouveau débloqué. Que se passe-t-il ? On déplace alors très lentement le piston jusqu'à ce que le volume occupé par l'eau soit
3. Thermodynamique du mouvement unidimensionnel d'une particule
En mécanique classique comme en mécanique relativiste, la loi fondamentale de la dynamique dans un référentiel galiléen appliqué à une particule en mouvement sur un axe sous l'action d'une force
12 - Montrer que les différentielles des énergies internes de la particule,
13 - Par analogie avec les exemples précédents, on définit la fonction
14 - On suppose à partir de maintenant que le mouvement est unidimensionnel ; les grandeurs
Exprimer dans le cas général
Fin de ce problème
PROBLÈME II : UNE APPROCHE DE LA RÉVERSIBILITÉ
La mole de gaz parfait considérée dans cette partie est caractérisée par son coefficient
3. Étude d'une transformation monotherme
Fig. 5 : évolution monotherme
18 - Le gaz parfait est placé dans un récipient à parois fixes. Une des parois est mise en contact avec un thermostat dont la température est notée
19 - On réalise la transformation précédente en mettant la paroi non calorifugée du récipient contenant le gaz avec une succession de
4. Étude d'une transformation monobare
Fig. 6 : évolution monobare
21 - Le gaz parfait est initialement en contact avec une source à la température
22 - On réalise la transformation précédente en déplaçant la paroi mobile par étapes successives. À l'étape
23 - Cette quantité d'entropie peut-elle s'annuler?
5. Étude d'une transformation plus générale
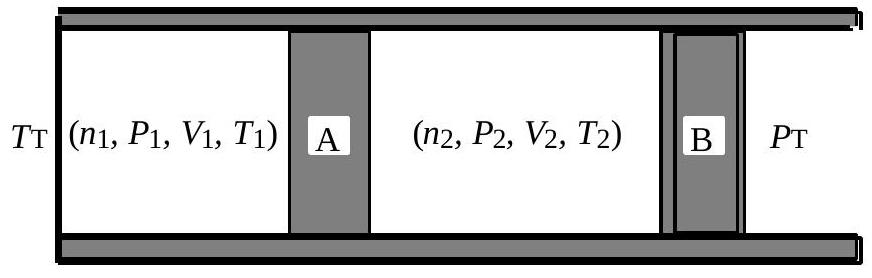
Fig. 7: Évolutions de gaz parfaits
La figure 7 illustre la situation initiale du système. La paroi A est diathermane. Les parois latérales et la paroi B sont calorifugées. Cette dernière, initialement bloquée, peut se déplacer sans frottement. La pression extérieure, notée
rature
rature
- 24 - Déterminer l’état final de chacun des deux gaz. Faire un bilan d’entropie.
- Analyser la nature d'éventuelles irréversibilités. - 26 - Est-il possible, tout en arrivant aux mêmes états finaux, de diminuer l'entropie créée?
6. Au-delà du gaz parfait...
Un ressort élastique de raideur
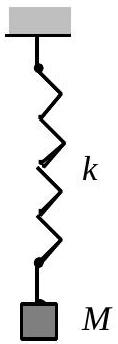
Fig. 8 : Ressort élastique
27 - Calculer la variation d'énergie potentielle associée au chargement progressif du ressort, calculer la variation d'énergie élastique et en déduire l'expression de l'énergie dissipée sous forme thermique.
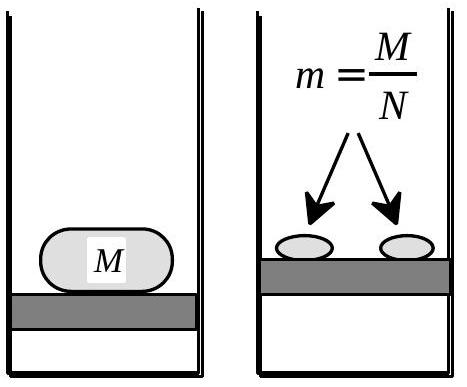
Fig. 9 : Compression d'un gaz parfait
Une mole de gaz parfait en contact avec un thermostat à la température
En comparant R1 et R2, proposer une analogie entre les deux systèmes et leurs variables caractéristiques ; étayer cette analogie par un argument énergétique et justifier qualitativement la différence des signes qui figurent dans ces deux relations.
