Version interactive avec LaTeX compilé
Epreuve de Physique II-A
L'utilisation des calculatrices est autorisée.
AVERTISSEMENT
Ce sujet comporte un problème de chimie et un problème de thermodynamique.
Il est vivement conseillé aux candidats de consacrer le même temps de travail au problème de chimie et au problème de thermodynamique, les barèmes des deux problèmes étant identiques.
Il est vivement conseillé aux candidats de consacrer le même temps de travail au problème de chimie et au problème de thermodynamique, les barèmes des deux problèmes étant identiques.
La composition doit impérativement être faite sur deux copies séparées et numérotées séparément.
Chaque copie (et chaque page intercalaire) doit porter l'indication "Thermodynamique" ou l'indication "Chimie".
Chaque copie (et chaque page intercalaire) doit porter l'indication "Thermodynamique" ou l'indication "Chimie".
Chaque candidat reçoit, avec l'énoncé, deux diagrammes (annexe 1 et annexe 2) à rendre avec la copie de Thermodynamique.
CHIMIE
L'ensemble des données numériques est fourni en annexe, page 6.
Les résultats seront donnés avec 3 chiffres significatifs et l'usage de la calculatrice est autorisé. Il sera tenu compte de la qualité de la rédaction.
Les résultats seront donnés avec 3 chiffres significatifs et l'usage de la calculatrice est autorisé. Il sera tenu compte de la qualité de la rédaction.
L'EAU
L'eau est le composé chimique le plus important des substances terrestres, toute vie animale ou végétale dépend de sa présence. Considérée et vénérée anciennement comme l'un des éléments vitaux, l'eau est devenue également de la plus grande importance aussi bien pour l'industrie que pour les besoins individuels.
I - Étude structurale de la molécule d'eau
Dans toute la suite, on pourra assimiler une température de
II - Étude des propriétés acido-basiques du solvant eau
A - Étude à la température de
(température correspondant sensiblement à 298 K )
On considère une solution aqueuse
Déterminer le volume de la solution commerciale
Déterminer le volume de la solution commerciale
B - Étude en fonction de la température
On suppose que l'enthalpie standard de la réaction d'autoprotolyse de l'eau liquide est indépendante de la température.
III - Étude de la solubilisation de gaz et de solides dans l'eau
A - Dissolution du dioxyde de carbone
On sait qu'à
Outre la réaction de dissolution, les réactions suivantes se produisent :
Outre la réaction de dissolution, les réactions suivantes se produisent :
Dans la suite, on suppose la pression partielle de
B - Dissolution des nitrates
Les nitrates étant généralement très solubles, une eau (initialement pure) a été polluée par du nitrate de plomb
C - Dissolution du chlorure de sodium
L'eau peut dissoudre en particulier jusqu'à 260 g par litre de sel marin
IV - Étude des propriétés oxydo-réductrices de l'eau
L'eau (ou ses ions) peut agir comme oxydant ou comme réducteur. Les valeurs des deux potentiels redox standard sont fournies en annexe. On raisonnera à
5.1. Situer ce couple sur le diagramme précédent, en admettant que la concentration en espèce dissoute est égale à
5.2. Sachant que le produit de solubilité de l'hydroxyde d'aluminium
5.3. Expliquer pourquoi une surface d'aluminium peut demeurer sans dommage au contact de l'eau de pluie, de pH supérieur à 5 .
5.4. En milieu très acide, après avoir trempé du papier aluminium ménager quelques secondes, on assiste à une vive réaction accompagnée d'un dégagement gazeux et à la disparition totale du métal. Écrire les équations-bilans des deux réactions de l'oxydant
5.1. Situer ce couple sur le diagramme précédent, en admettant que la concentration en espèce dissoute est égale à
5.2. Sachant que le produit de solubilité de l'hydroxyde d'aluminium
5.3. Expliquer pourquoi une surface d'aluminium peut demeurer sans dommage au contact de l'eau de pluie, de pH supérieur à 5 .
5.4. En milieu très acide, après avoir trempé du papier aluminium ménager quelques secondes, on assiste à une vive réaction accompagnée d'un dégagement gazeux et à la disparition totale du métal. Écrire les équations-bilans des deux réactions de l'oxydant
ANNEXE
Données thermodynamiques à 298 K
Enthalpie standard de formation de
Enthalpie standard (de dissociation) de la liaison
Enthalpie standard (de dissociation) de la liaison
Enthalpie standard de formation de
Autres enthalpies standard de formation, exprimées en
Solutions aqueuses:
Masses molaires des éléments en g.mol
Rayons ioniques
Constantes physico-chimiques
Enthalpie standard (de dissociation) de la liaison
Enthalpie standard (de dissociation) de la liaison
Enthalpie standard de formation de
Autres enthalpies standard de formation, exprimées en
Solutions aqueuses:
Masses molaires des éléments en g.mol
Rayons ioniques
Constantes physico-chimiques
THERMODYNAMIQUE
A la fin de l'épreuve, les candidats devront joindre à leur copie, après les avoir complétés, les deux diagrammes figurant en annexes 1 et 2 , qui leur ont été remis avec l'énoncé.
OPTIMISATION DE CYCLES INDUSTRIELS DE REFRIGERATION
On se propose d'étudier les performances thermodynamiques de cycles industriels de réfrigération d'un fluide diphasé.
Après avoir étudié attentivement un cycle donné pour un fluide frigorigène usuel, le Forane 502, on s'intéresse à l'influence sur les performances de ce cycle de la nature du fluide.
Après avoir étudié attentivement un cycle donné pour un fluide frigorigène usuel, le Forane 502, on s'intéresse à l'influence sur les performances de ce cycle de la nature du fluide.
Schéma de l'installation
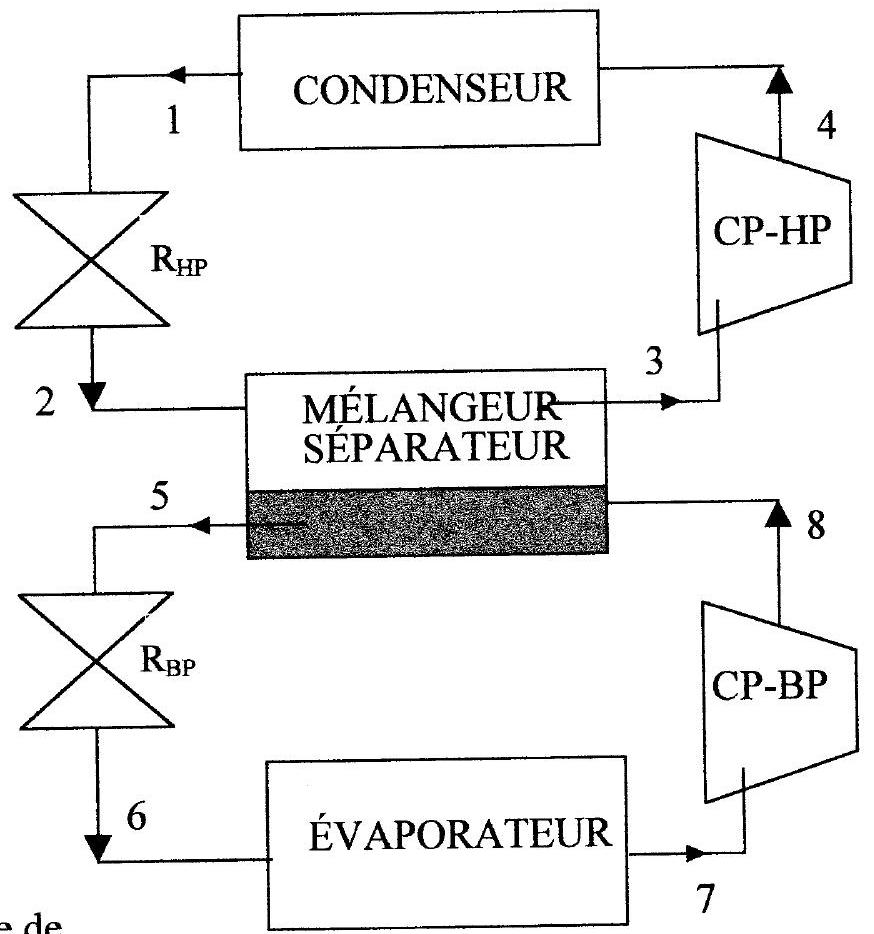
Figure 1 : cycle de
réfrigération à 2 étages
réfrigération à 2 étages
Le condenseur et l'évaporateur sont des échangeurs permettant respectivement la condensation et l'évaporation totale du fluide qui les traverse; dans les états 1 et 7 , le fluide est respectivement à l'état de liquide saturant et de vapeur saturante sèche.
Ces échangeurs sont calorifugés. Les évolutions du fluide y sont supposées réversibles.
Ces échangeurs sont calorifugés. Les évolutions du fluide y sont supposées réversibles.
- le fluide pénètre dans
sous une haute pression égale à (état 1 ) et en ressort sous une pression intermédiaire (état 2) - le fluide pénètre dans
sous la pression intermédiaire égale à (état 5) et en ressort sous une basse pression (état 6)
CPHP et CPBP sont des compresseurs, respectivement haute et basse pression, qui assurent des compressions également supposées adiabatiques et réversibles du fluide à l'état gazeux:
- le fluide pénètre dans CPHP sous une pression intermédiaire
(état 3 ) et en ressort sous la haute pression (état 4) - le fluide pénètre dans CPBP sous basse pression
(état 7) et en ressort sous la pression intermédiaire (état 8)
À la sortie de
1. Questions préliminaires
1.1. Soit un fluide en écoulement permanent entre deux points, qualifiés d'entrée et de sortie. On note
On suppose de plus que les variations d'énergie cinétique et d'énergie potentielle de pesanteur sont négligeables.
Ces hypothèses sont vérifiées dans tout le problème.
Montrer que
1.2. On considère une machine frigorifique ditherme où le fluide suit un cycle réversible de Carnot entre deux sources idéales de températures constantes
Tracer le cycle correspondant dans un diagramme T,s.
Définir le coefficient de performance ( COP ) ou efficacité frigorifique de la machine, et le déterminer en fonction de
On suppose de plus que les variations d'énergie cinétique et d'énergie potentielle de pesanteur sont négligeables.
Ces hypothèses sont vérifiées dans tout le problème.
Montrer que
1.2. On considère une machine frigorifique ditherme où le fluide suit un cycle réversible de Carnot entre deux sources idéales de températures constantes
Tracer le cycle correspondant dans un diagramme T,s.
Définir le coefficient de performance ( COP ) ou efficacité frigorifique de la machine, et le déterminer en fonction de
On revient maintenant à l'installation dont le schéma a été donné à la figure 1, ci-dessus.
1.3. Montrer que les transformations dans le condenseur, l'évaporateur et le mélangeur sont isobares.
1.4. Étude du diagramme des frigoristes :
1.3. Montrer que les transformations dans le condenseur, l'évaporateur et le mélangeur sont isobares.
1.4. Étude du diagramme des frigoristes :
Figure 2 : allure sommaire du diagramme des frigoristes
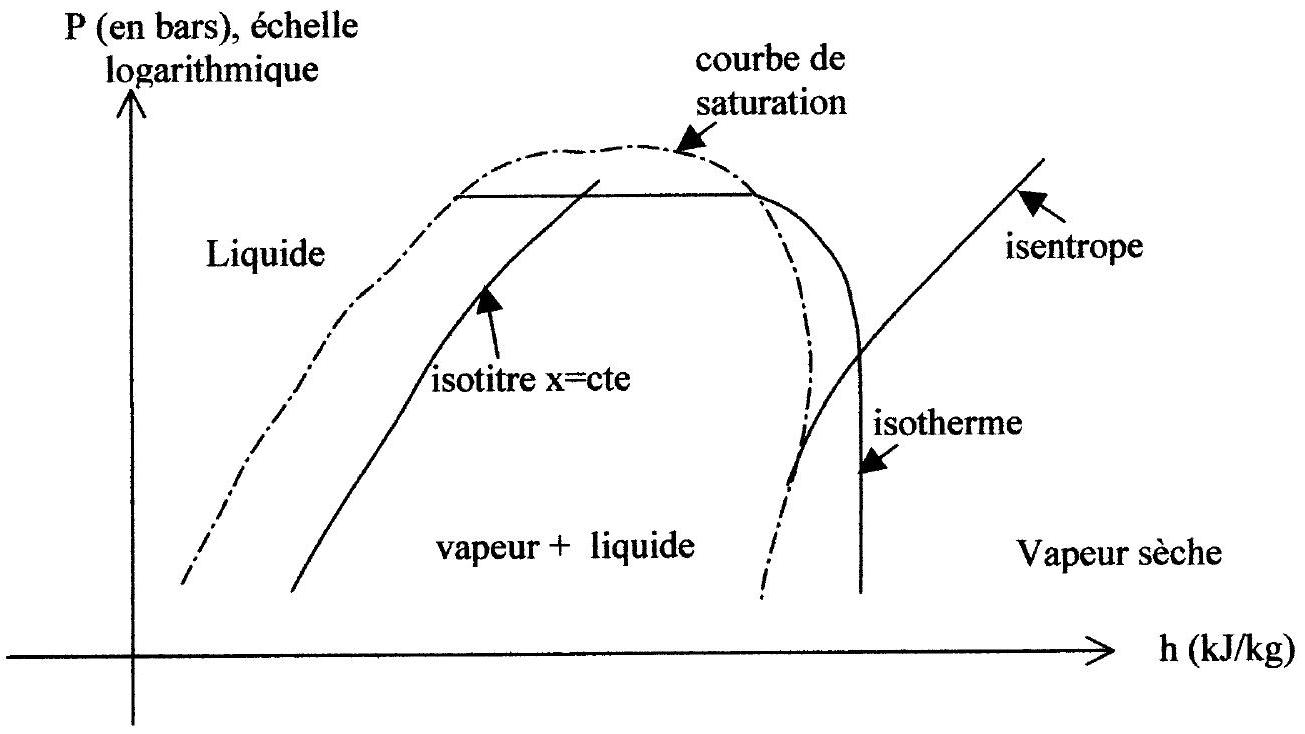
La figure 2 ci-dessus facilite la lecture des diagrammes fournis en annexes 1 et 2 , qui seront utilisés ultérieurement dans l'étude du problème. L'abscisse est l'enthalpie massique
1.4.1. Quelle est la forme des isothermes à l'intérieur de la courbe de saturation ? On justifiera précisément la réponse fournie.
1.4.1. Quelle est la forme des isothermes à l'intérieur de la courbe de saturation ? On justifiera précisément la réponse fournie.
On s'intéresse maintenant au cas particulier d'un gaz parfait; on note
1.4.2. Trouver l'équation d'une isotherme de ce gaz dans le diagramme étudié ; y a-t-il accord avec les isothermes du diagramme réel du fluide Forane 502, représentées en annexe 1 ? Discuter.
1.4.2. Trouver l'équation d'une isotherme de ce gaz dans le diagramme étudié ; y a-t-il accord avec les isothermes du diagramme réel du fluide Forane 502, représentées en annexe 1 ? Discuter.
Remarque : sur les diagrammes fournis en annexes 1 et 2 , figurent également les courbes isochores ( v est donné en
Données nécessaires à la suite de l'étude
Débit du cycle basse pression :
Puissance thermique de réfrigération
2. Étude du cycle haute pression (1-2-3-4)
Le fluide frigorigène étudié ici est le Forane 502.
2.1. Tracer le cycle 1.2.3.4 sur le diagramme fourni en annexe 1 (voir feuillet mobile).
2.2. Présenter, sous forme de tableau, les caractéristiques
2.3. Retrouver le titre en vapeur
2.1. Tracer le cycle 1.2.3.4 sur le diagramme fourni en annexe 1 (voir feuillet mobile).
2.2. Présenter, sous forme de tableau, les caractéristiques
2.3. Retrouver le titre en vapeur
3. Etude du cycle basse pression (5-6-7-8)
Le fluide frigorigène étudié est toujours le Forane 502.
On représentera, au fur et à mesure de la progression, le cycle
3.1 Déterminer les valeurs de
3.2 Faire de même pour le fluide dans l'état 7 ; en déduire les valeurs pour l'état 8. Présenter, sous forme de tableau, les caractéristiques (
3.3 A l'aide d'un bilan énergétique justifié au niveau du mélangeur-séparateur, déterminer la valeur du débit massique
On représentera, au fur et à mesure de la progression, le cycle
3.1 Déterminer les valeurs de
3.2 Faire de même pour le fluide dans l'état 7 ; en déduire les valeurs pour l'état 8. Présenter, sous forme de tableau, les caractéristiques (
3.3 A l'aide d'un bilan énergétique justifié au niveau du mélangeur-séparateur, déterminer la valeur du débit massique
4. Bilan énergétique
4.1 Calculer la puissance mécanique échangée dans CPHP et CPBP.
4.2 Calculer la puissance thermique échangée dans l'évaporateur et dans le condenseur.
4.3 Calculer le COP (coefficient de performance) de l'installation frigorifique étudiée.
4.4 Calculer le COP du cycle réfrigérant idéal de Carnot ayant mêmes températures de source froide et de source chaude. En déduire le rendement du cycle étudié par rapport au cycle de Carnot :
4.2 Calculer la puissance thermique échangée dans l'évaporateur et dans le condenseur.
4.3 Calculer le COP (coefficient de performance) de l'installation frigorifique étudiée.
4.4 Calculer le COP du cycle réfrigérant idéal de Carnot ayant mêmes températures de source froide et de source chaude. En déduire le rendement du cycle étudié par rapport au cycle de Carnot :
5. Optimisation du fluide frigorigène
Certaines installations industrielles utilisent préférentiellement l'ammoniac (R 717) comme fluide frigorigène. On se propose de dégager l'intérêt éventuel de cette technologie.
5.1 Tracer sur le diagramme de
5.2 Dans ces conditions les débits haute et basse pression de ce cycle valent:
5.3 Discuter l'intérêt et les inconvénients d'une telle technologie.
5.1 Tracer sur le diagramme de
5.2 Dans ces conditions les débits haute et basse pression de ce cycle valent:
5.3 Discuter l'intérêt et les inconvénients d'une telle technologie.
6. Optimisation de la compression
On se propose de dégager l'intérêt d'une compression à deux étages, nécessitant la présence des deux compresseurs CPHP et CPBP.
Pour cela, on envisage un cycle simple de réfrigération à un étage, fonctionnant entre les mêmes pressions extrêmes
Le fluide frigorigène est de nouveau le Forane 502.
Le point
Pour cela, on envisage un cycle simple de réfrigération à un étage, fonctionnant entre les mêmes pressions extrêmes
Le fluide frigorigène est de nouveau le Forane 502.
Le point
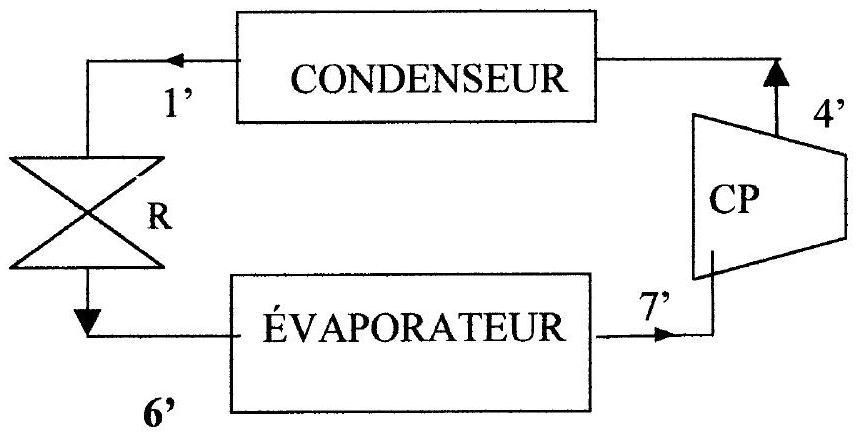
Figure 3 : cycle de réfrigération à 1 étage
6.1 Tracer le cycle correspondant sur le diagramme fourni en annexe 1 (utiliser une deuxième couleur d'encre).
6.2 Calculer graphiquement les enthalpies massiques des points
6.3 En déduire l'énergie thermique massique de réfrigération de ce cycle, ainsi que le travail indiqué massique au niveau du compresseur.
6.4 Déterminer le COP de cette installation. Commenter.
6.3 En déduire l'énergie thermique massique de réfrigération de ce cycle, ainsi que le travail indiqué massique au niveau du compresseur.
6.4 Déterminer le COP de cette installation. Commenter.
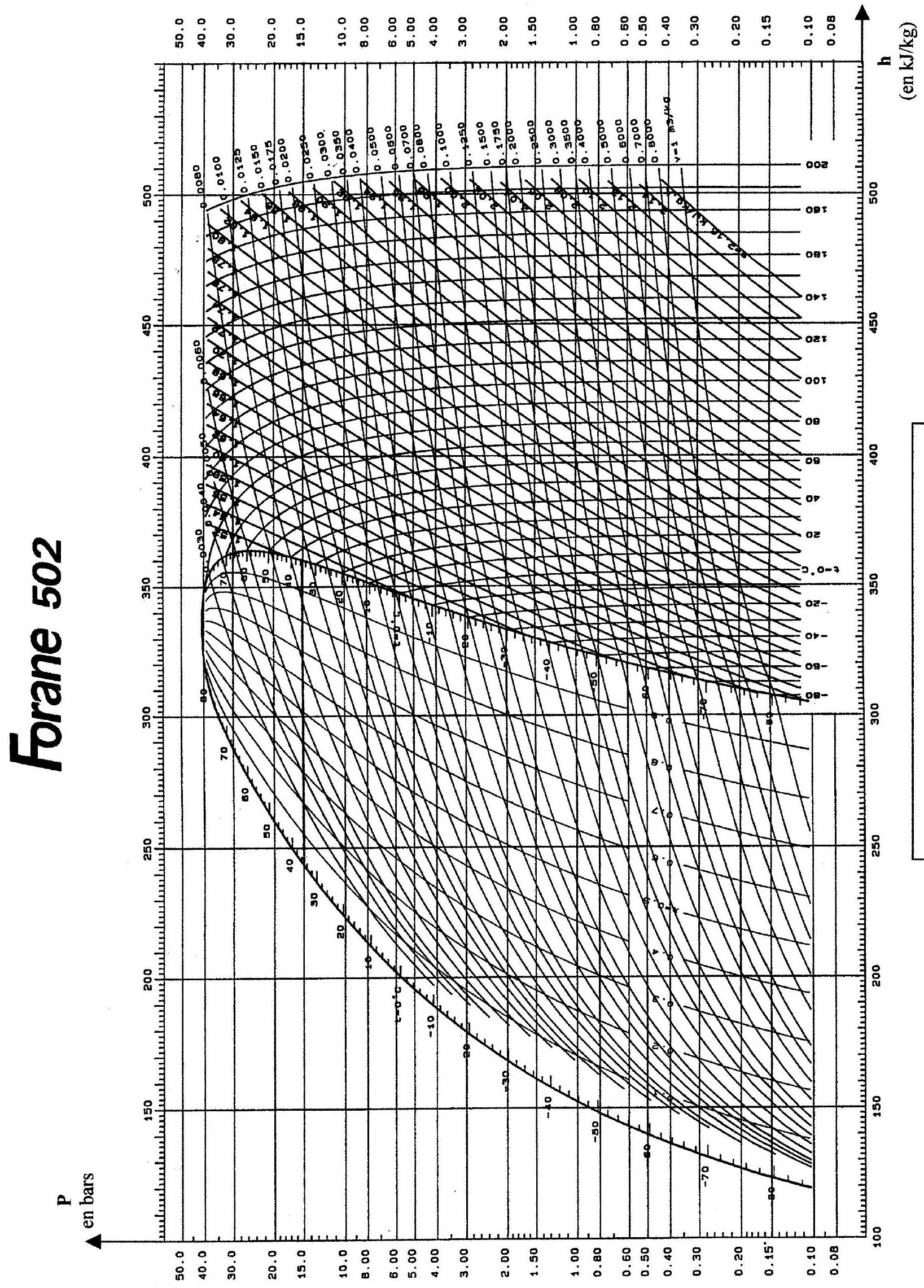
ANNEXE 1
Ammoniac (R 717)
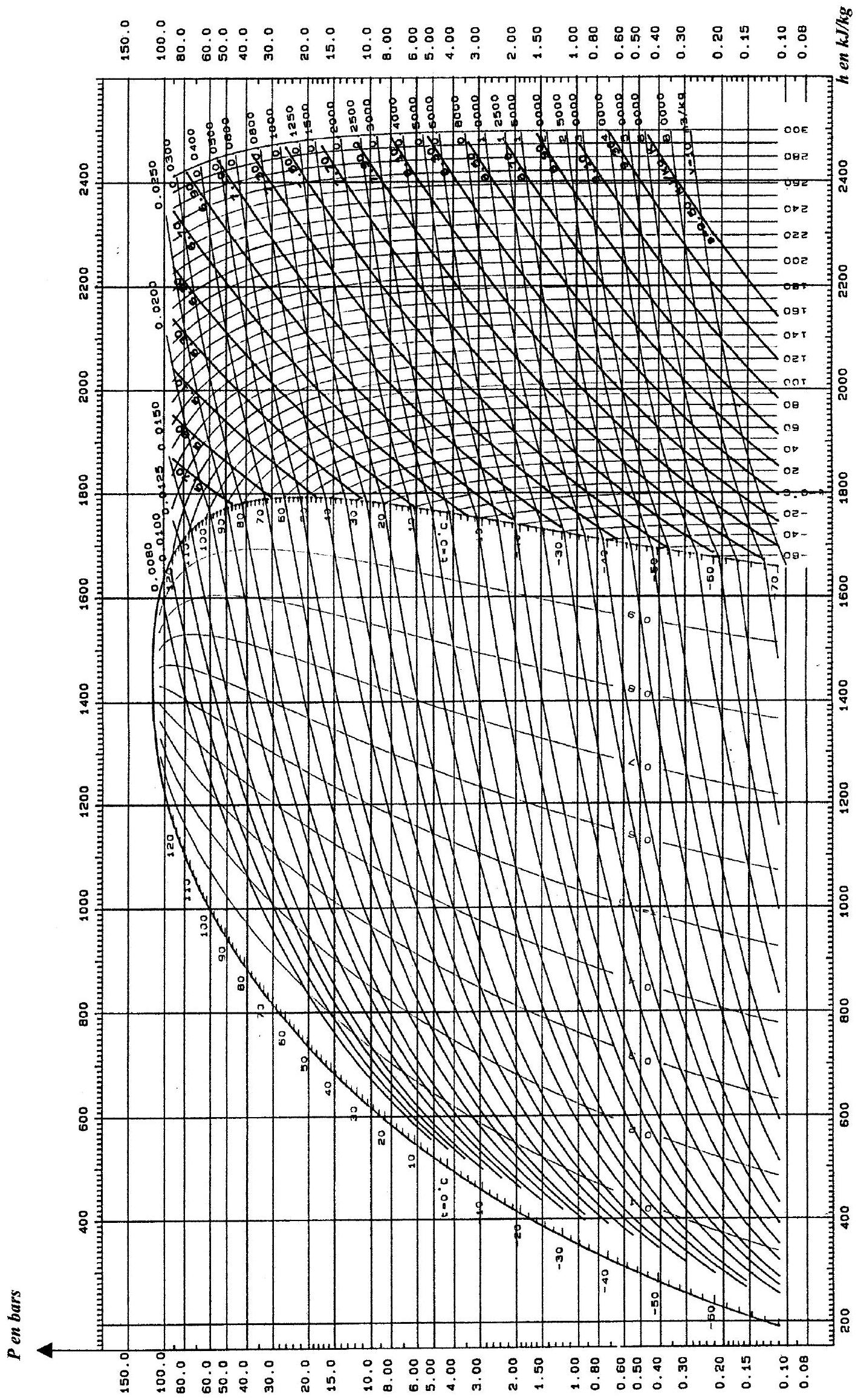
ANNEXE 2
